近年来,大量实验证据表明,树突分枝是大脑处理信息的基本结构与功能单元,探索产生树突分枝功能特异性的原理,对于深入理解学习与记忆的生物学本质、预防和治疗大脑衰老及神经退行性疾病具有重大科学意义。
突触群体的计算特性决定了树突分枝的功能特异性,但突触群体的结构与功能高度差异化,它们如何有序分布在树突分枝上?是否存在某种组织原则来决定这些突触的空间分布和功能状态,并且既能规范它们的稳态分布,同时又使它们能够适应信息处理过程中的复杂动态变化?
一直以来 这些都是神经科学领域亟待解决的难题 4月22日,一项发表在 Nature Communications杂志上的 最新成果 (点击文末“阅读原文”阅读论文) 为这些问题提供了解决思路 并找到了一种可能的答案
深圳理工大学(筹)生命健康学院助理教授周航研究团队与合作者通过大量实验研究,首次明确揭示了大脑海马区神经元树突分枝上突触群体结构与功能的组织原则,提出了用来精确描述突触群体沿树突分枝的时空分布模式的新概念——“突触构象”,证明了突触构象是树突分枝的计算功能特异性的决定因素和新型生物标志物,发现了一种调控突触构象的关键内源性因子及其背后的分子通路,并通过调控该通路预防了老龄化导致的动物学习与记忆能力衰退。
该研究对于 理解学习与记忆的生物学本质 研发抵抗大脑衰老及神经退行性疾病的 新型药物与治疗方法 具有重要的基础科学和转化意义
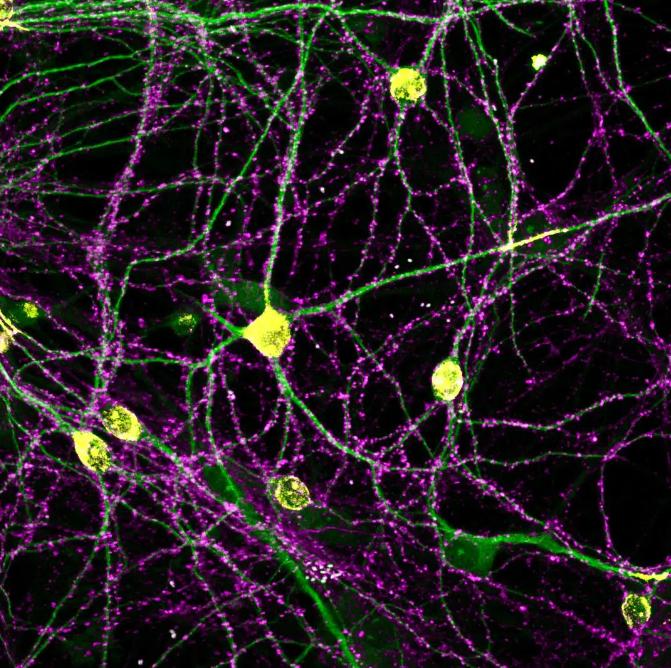
研究团队首先在单突触水平上对大脑海马区椎体神经元树突分枝上的突触进行了系统研究,综合运用单突触囊泡功能成像、单突触钙成像、基于序列扫描电镜的突触三维重构、动物行为学等方法,揭示了神经元树突分枝上突触群体的组织原则,即单位面积树突分枝上的突触传递总强度在基础状态下总是相对恒定的。
在这一原则之下,突触群体沿树突分枝的时空分布模式呈现出连续变化的构象,其中两类典型的构象表现分别为“突触数量少、传递强度高”和“突触数量多、传递强度低”。 具有前一类突触构象的树突分枝的计算特性表现为突触传递效率高、可塑性低、编码容量低,从而利于信息的存储和保持,与记忆能力密切相关;而具有后一类突触构象的树突分枝则突触传递效率低、可塑性高、编码容量高,更利于信息的编码,与学习能力密切相关。
因此,研究团队认为,突触构象决定了神经元树突分枝的功能特异性,而不同构象(作为一种新型生物标志物)则表征了树突分枝不同的神经计算与信息处理能力。
在机理上,研究团队首次发现细胞内Mg2+是决定突触构象的关键内源性分子,并详细阐明了其背后的分子通路。上调细胞内Mg2+水平,能够在树突分枝上增加突触数量、减小突触传递强度、增加突触可塑性和编码容量;反之,下调Mg2+水平,则会减少突触数量、增加突触传递强度、减小突触可塑性和编码容量,从而实现单一内源性因子对树突分枝计算特性的调控。 值得注意的是,这种调控是动态且可逆的,其突触构象转换的时间尺度在几十分钟到几个小时范围内,与短时记忆的时间尺度相似,提示突触构象的动态转换可能对短时记忆形成和消除过程中的信息更迭具有重要意义。 此外,有趣的是,低Mg2+水平对应的突触构象特征与大脑衰老及神经退行性脑疾病过程中的突触变化特征相似(即突触数量降低、突触传递强度增加、突触结构大小增加),提示调控神经元细胞内Mg2+水平可能会有助于对抗大脑衰老及神经退行性疾病。 事实上,研究团队还在整体动物水平上验证了这一发现,证实了通过口服一种能够促进大脑中Mg2+水平上升的化合物(左旋苏糖酸镁)可以改善老年大鼠(26月龄)的学习与记忆能力,并且显著阻止脑衰老过程中突触总体数量变少、结构大小增加的趋势。
目前,上述镁离子化合物(即左旋苏糖酸镁,药物编号MMFS-01)正在美国开展FDA批准的三项2b/3期临床试验,评估补充大脑中的Mg2+对于阿尔茨海默病、焦虑/抑郁、成人注意力缺陷多动症(ADHD)的治疗效果。已发表的“安慰剂对照/随机双盲”临床试验表明,补充大脑中的Mg2+能够显著改善轻度认知障碍患者及轻中度阿尔茨海默病患者大脑认知功能退行性状态、改善ADHD患者症状,临床表现为综合认知功能评分显著提高、睡眠等大脑状态显著改善等。
